A1.8 I nuclei atomici. Decadimenti radioattivi.
I nuclei degli atomi che compongono i vari elementi chimici che formano la materia sono costituiti da un “assiemaggio” di protoni e neutroni. Detto, per ogni nucleo, Z il numero di protoni “p” e N il numero di neutroni “n”, Z determina la carica elettrica totale del nucleo (= +Ze), mentre N+Z=A numero atomico rappresenta il numero totale di nucleoni (“p” o “n”) presenti nel nucleo, determinandone la massa.
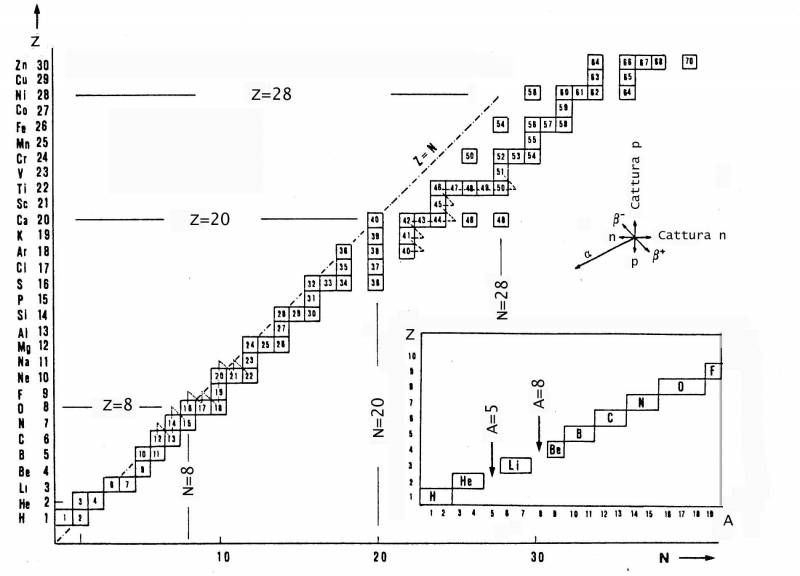
E' noto che dalla carica elettrica del nucleo dipendono le proprietà degli elettroni orbitanti attorno al nucleo stesso e, in definitiva, le proprietà chimiche dei vari elementi. Ad ogni Z corrisponde dunque un ben determinato elemento classificato secondo la usuale nomenclatura chimico-fisica (idrogeno, elio, etc.), cui possono corrispondere nuclei con diverso A (detti isotopi). In fig. 1.22 è riportata una tabulazione dei nuclei stabili con numero atomico A minore o uguale a 70.
Attraverso reazioni di impatto tra nucleoni e/o nuclei è possibile produrre nuovi nuclei con un rapporto protoni/neutroni che rende i nuclei instabili. Tali nuclei tendono in generale a decadere per riportarsi al rapporto che caratterizza il nucleo stabile. Nel caso di un eccesso di neutroni questi vengono trasformai in protoni grazie al decadimento β-
nel quale vengono emessi un elettrone col suo antineutrino. In caso di eccesso di protoni si ha il corrispondente decadimento β+
con emissione di un positrone e di un neutrino. Simili reazioni sono caratterizzate da una probabilità di decadimento che dipende solo dal processo considerato, e non dalle condizioni chimiche o fisiche della materia.
Fig. 1.22 Mappatura nel piano Z (numero di protoni) N (numero di
neutroni) dei primi trenta elementi chimici del sistema periodico.
Per ogni elemento (per ogni Z) è riportato il simbolo chimico e,
nelle corrispondenti caselle, il numero di massa A (=Z+N) dei vari
isotopi. In alto a destra sono riportate le traiettorie
corrispondenti ai più comuni processi di decadimento o cattura.
L'assenza di isobari contigui testimoni l'efficienza dei
processi β nel portare i nuclei nelle configurazioni
nucleari a maggior energia di legame. Sono anche indicati i
numeri magici di neutroni o protoni in corrispondenza dei quali i
nuclei mostrano una peculiare stabilità. Le spezzate a tratti e
punti mostrano le traiettorie corrispondenti ad una serie successiva
di catture di protoni o neutroni. Nel riquadro una mappatura nel
piano A,Z evidenzia l'assenza di nuclei con A=5 e 8.
Poichè la probabilità è pari alla frequenza degli eventi, dati N nuclei suscettibili di un particolare decadimento radioattivo, in un tempo dt ne decadranno
essendo dN/N la frequenza degli eventi e la probabilità di
decadimento per unità di tempo. Ponendo
si ha
e, integrando su un tempo finito
dove N è il numero di nuclei sopravvissuti al tempo “t”, N0
il numero di quelli presenti all'istante iniziale, è
l'inverso della probabilità di decadimento per unità di tempo
e prende il nome di vita media del nuclide radioattivo in
esame. Analoghe relazioni valgono in generale anche per i
decadimenti attraverso altri canali che caratterizzano
l'instabilità di taluni nuclei e, in particolare, per il
decadimento con emissione di particelle α che caratterizza
l'instabilità degli elementi a più alto numero atomico
(famiglie radioattive dell'Uranio-Torio).